VietTimes – Traduction Covid-19 affecte non seulement l’approvisionnement en matières premières, mais aussi les progrès de la construction d’usines pharmaceutiques EU-GMP des entreprises nationales..

En tant qu’entreprise purement vietnamienne, Pharbaco deviendra l’acteur le plus redoutable du marché pharmaceutique vietnamien une fois que la super usine nouvellement construite sera reconnue avec les normes EU-GMP.P
Selon SSI Securities JSC (SSI), la demande de matières premières pour la production pharmaceutique au Vietnam dépend de 80 à 90% de sources importées. C’est toujours un problème à long terme pour le Vietnam. Parce que produire des herbes médicinales nécessite beaucoup d’investissements et de capacités technologiques (le Vietnam n’a pas d’avantage concurrentiel par rapport à d’autres pays, comme la Chine et l’Inde).
Dans le contexte de l’épidémie complexe de Covid-19, les entreprises pharmaceutiques subiront de nombreux impacts négatifs sur l’approvisionnement en matières premières. L’impact dépendra plus ou moins de la politique de stockage des matières premières de chaque entreprise.
Mais l’épidémie de Covid-19 a un impact significatif sur les progrès du développement des usines pharmaceutiques avec les normes UE-BPF des entreprises pharmaceutiques nationales. Cela est dû au fait que le mouvement des experts et des partenaires à travers les pays a été entravé par l’épidémie, entravé le développement des progrès et des normes validées.
Selon les statistiques de SSI, au 30 novembre 2019, le nombre de lignes de production ou d’usines répondant aux normes de qualité de production UE – GPM / Japon – GMP ou PIC / s atteignait 19 usines sur 203. produits pharmaceutiques, appartenant à plus de 170 sociétés pharmaceutiques nationales et multinationales.
L’évaluation par SSI des produits de haute qualité sera un avantage concurrentiel pour les sociétés pharmaceutiques nationales.
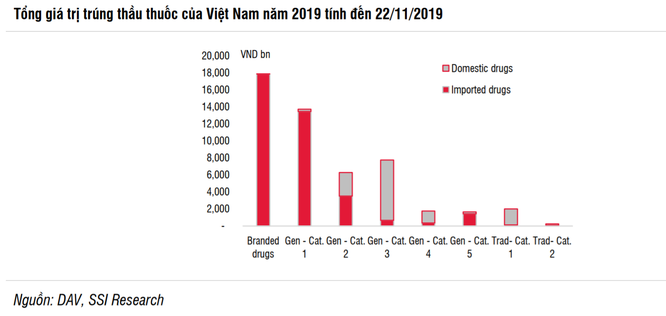
Les groupes de médicaments 1 et 2 sont toujours le «terrain de jeu» des entreprises étrangères
Plus précisément, la circulaire indique clairement que dans les groupes 5 et 2, les médicaments importés peuvent ne pas être autorisés à soumissionner si les médicaments produits dans le pays respectent respectivement les normes OMS-GMP et UE-GMP pour la même activité. substances clés (API), et si la capacité de production de l’entreprise peut répondre pleinement à la demande.Le 1er octobre 2019, la circulaire 15/2019 / TT-BYT du ministère de la Santé réglemente les enchères de médicaments Établissements de santé publique officiellement efficaces. Il s’agit de la circulaire révisée de la circulaire 11/2016 / TT-BYT précédemment publiée par le ministère de la Santé.
En outre, les hôpitaux et cliniques publics du Vietnam ne soumissionneront pas pour les médicaments importés qui sont couverts par le budget de l’État ou la caisse d’assurance maladie. Les établissements médicaux ne seront pas invités à soumissionner pour les médicaments importés s’il existe au moins 3 sociétés pharmaceutiques nationales qui sont en mesure de fournir ces médicaments à des fins de traitement et de respecter les normes de prix et de disponibilité.
SSI estime que la réglementation des appels d’offres publics pour les médicaments est un avantage pour les fabricants de médicaments au Vietnam qui répondent à des normes de qualité de production élevées. Dans le même temps, cette politique vise également à encourager le traitement des médicaments étrangers, ainsi que le transfert de technologie des médicaments étrangers, pour la production au Vietnam.

Parmi les sociétés cotées, Imexpharm Pharmaceutical JSC (Ticker: IMP) et Pymepharco JSC (Ticker: PME) sont les sociétés qui ont obtenu la certification EU – GMP pour 2 lignes de production, tandis que Hau Pharmaceutical JSC. Giang (Ticker: DHG) est certifié pour les normes PIC / s et Japon-GMP.
En outre, comme VietTimes l ‘a mentionné, la Central Pharmaceutical Joint Stock Company I (Pharbaco – Ticker: PBC) construit également un projet d’ usine pharmaceutique conforme à la norme EU – GMP.
Pharbaco est l ‘une des rares entreprises nationales à mettre en œuvre le projet d’ une usine pharmaceutique répondant aux normes UE – BPF par elles – mêmes sans la participation d ‘actionnaires étrangers comme de nombreuses autres entreprises.
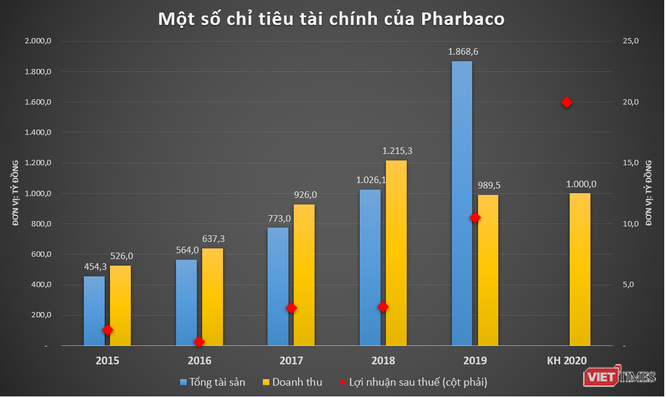
Actuellement, Pharbaco a mis en œuvre la phase 1 du projet avec un investissement total de 1 200 milliards de VND. En raison de l’impact de l’épidémie de Covid-19, il est presque impossible pour les experts de venir au Vietnam pour coordonner le fonctionnement des machines, cependant, Pharbaco vise toujours à terminer et à vérifier l’usine UE-GMP au troisième trimestre. / 2020.

Vue d’ensemble du projet Pharbaco EU – GM Factory (Source: AT Bach Khoa)
Concernant la deuxième phase du projet, Pharbaco prévoit de se déployer rapidement, l’investissement total devrait être d’environ 800 milliards de VND. Le financement de la mise en œuvre devrait être mobilisé auprès d’actionnaires stratégiques et de prêts bancaires.
Posséder une usine EU-GMP aidera les produits pharmaceutiques de Pharbaco à se qualifier pour les appels d’offres dans les groupes 1 et 2 sur le canal ETC (hôpitaux, cliniques) et plus près de l’objectif de devenir 1 entreprise sur 10. produits pharmaceutiques avec la plus grande production au Vietnam.
Selon un rapport de Mirae Asset, cette unité a estimé que la valeur totale de l’industrie pharmaceutique vietnamienne en 2019 atteignait environ 6,95 milliards USD, en hausse de 11% par rapport à 2018. Dans laquelle, les médicaments importés dominent toujours le marché pharmaceutique. Par conséquent, la possession d’une usine EU-GMP contribue à redistribuer la part de marché de l’industrie pharmaceutique au Vietnam.
D’ici 2020, le ministère de la Santé vise à porter la consommation intérieure de médicaments à 22% dans les hôpitaux centraux et à 50% et 75% dans les hôpitaux.